타겟항암제 Q901 개발 스토리
페이지 정보
- Author
- QURIENT
- Date
- 2022-08-25 11:28
- Views
- 3,444
본문
타겟항암제 Q901 개발 스토리
주) 큐리언트 남기연 대표이사
개요
지난 20여년 간 암 치료를 위한 항암제의 개념은 큰 변화를 거쳐 왔습니다. 화학요법 (chemotherapy)이라는 범주에 들어가는 항암제들이 가장 먼저 개발이 되어 사용되기 시작되었고 현재도 많은 종류의 암 치료법에서 주력을 이루고 있습니다. 이 화학요법의 특징은 모든 세포에 독성을 나타내지만, 빠르게 분열하는 암세포에 특히 더 강한 독성을 나타내, 아군보다 적군에 더 큰 타격을 입히는 것입니다. 마치 융단 폭격과 같은 치료법으로 효능과 부작용이 동반 됩니다. 2000년대에 진입하면서 항암 치료의 목적으로 환자의 생명연장 뿐 아니라 환자 삶의 질 개선을 목표로 한 항암제 출시가 본격화 되기 시작하였습니다. 2001년 허가된 글리벡 (Gleevec)을 시점으로 수텐트 (Sutent)와 같은 저분자 표적치료제, 2004년 허가된 아바스틴 (Avastin) 과 같은 항체 표적치료제들이 출시되며, 암세포를 특이하게 공격해 사멸시키면서 정상세포에 타격을 최소화하는 치료제가 개발 되었습니다. 암 치료의 개념이 융단 폭격에서 크루즈 미사일로 진화한 셈인 것 입니다. 하지만 이러한 표적 치료제들은 암세포만의 특이한 변이 및 특징이 있을 때 효과적으로 작용할 수 있도록 디자인 되어 있어, 암세포가 변이 및 특징을 잃거나 변화가 생기면 효능을 잃어 버리게 됩니다. 미생물과 같이 변이가 많이 일어나는 암세포이기에 이러한 표적치료제에 대한 내성 발생은 빈번히 일어납니다. 표적치료제로 좋은 효과를 보고 있던 환자들이 일정 기간이 지나면 암이 재발하는 경우가 이런 케이스에 해당됩니다. 단 표적치료제로 효과를 보고 있던 기간 중 환자의 삶의 질은 그 전보다 좋은 경우가 많습니다.
그렇다면, 변하지 않는 것을 타겟으로 항암제를 개발할 수는 없을까요? 새로운 표적치료제의 개발 방향은 변이가 일어나지 않은, 즉 암 발생과정에서 핵심 역할을 하지만 변이가 일어나지 않은 정상 (Wild type) 단백질을 표적으로 하는 것입니다. 이런 타겟 단백질들은 변이가 일어났을 시 암세포에게 조차 치명적일 수 있어 변이가 안 일어나는 빈도가 매우 낮은 경우가 많습니다. 따라서 이런 정상 단백질을 표적으로 한다면 이 표적 자체에 일어나는 추가 변이에 의한 내성 발생은 줄어들 수 있을 것이라 예상 됩니다. 문제는 이런 종류의 타겟은 잘 드러나지 않는다는 것 입니다. 돌연변이와 같이 환자의 유전자 검사로 비교적 쉽게 드러나지 않고, 심도있는 기전 연구를 통해서만 그 존재를 알 수 있습니다.
Q901의 개발 경과 및 시장에서의 위치
2014년 큐리언트가 막스플랑크연구소로부터 CDK7 저해제 프로그램을 도입할 당시 회사 내부에서도 많은 갑론을박이 있었습니다. CDK7은 세포 분열주기에 키가 되는 주요 단백질일 뿐만 아니라 세포 내 모든 단백질 및 조절인자를 생산하는데 첫 단계인 전사 (transcription)을 조절하는데 주요 역할을 하는 것으로 알려져 있었기 때문입니다. 저해제를 개발하기에는 너무 핵심적 역할을 하는 단백질이 아닌가 하는 우려였습니다. 하지만 막스플랑크 연구소의 기초 연구 결과를 볼 때 CDK7의 저해는 암세포 특이적 세포 사멸 효과를 보인는 것으로 나타나, 위에서 언급한 좋은 정상 단백질 표적이 될 수 있을 것이라 판단하였습니다.
도입 당시 CDK7은 학계에서 새롭게 조명 받는 단백질이였습니다. 특히 MIT, 하버드의대 등에서 발표된 기전 연구 내용들에서는 CDK7이 특정 발암 유전자들의 (Myc 유전자 등) 전사 조절에 특이하게 관여한다고 밝히고 있어 CDK7을 타겟으로 한 신약개발이 막 시작되는 시점이기도 했습니다. 큐리언트도 막 CDK7 저해제 개발을 시작한 만큼 새로운 기전 연구도 병행하며 개발을 진행하였습니다. 큐리언트의 개발 방향의 촛점은 가장 선택성이 높은 CDK7저해제를 만드는데 맞춰졌습니다. 인간에게는 27종이 넘는 CDK가 있고 2000년대 초반 글로벌 제약사의 개발 경험을 비추어 볼 때 선택성이 없는 CDK 저해제는 안전성 이슈에서 자유로울 수 없었던 실패 사례 때문이였습니다. 큐리언트 연구팀의 각고의 노력 끝에 가장 CDK7 선택성이 높은 저해제를 개발하게 되었으나, 막상 테스트를 해보니 MIT, 하버드의대 등에서 발표된 기전 연구들이 하나도 재현이 되지 않았습니다. 여러번의 반복된 연구에서도 CDK7 저해제는 Myc 유전자 등의 전사 조절을 하지 않는 것으로 나타났습니다. 오히려 CDK7 저해제는 세포 분열 주기 조절을 주관하는 마스터 키 역할을 해 세포 분열 주기가 비정상적으로 형성된 암세포를 사멸시키는 기전으로 결론이 났습니다. 세계적 연구팀들의 결과가 재현이 안되는 당황스러운 상황이였습니다. 그 즈음 MIT, 하버드의대에서 설립된 바이오기업으로 CDK7 저해제를 개발하고 있던 시로스 (Syros)사의 사업개발 담당 임원의 미팅 요청이 있었습니다. 시로스사 역시 추가 연구 과정에서 같은 결론에 다다랐고, CDK7 저해제 시장은 넓고 경쟁사는 적으니 서로 정보를 공유하며 협력하자는 제안이였습니다. 결국 시로스사의 첫번째 후보물질의 선택성이 부족해 일어난 해프닝으로 결론이 나며, 하버드의대팀에서 결과를 인정하는 논문을 발표하였습니다. 큐리언트의 연구 역량이 돋보이는 사례라 할 수 있겠습니다.
우여곡절 끝에 CDK7 저해제 중 가장 선택성이 높으며, 임상 진입에 적합한 물성을 가진 Q901이 개발되었고, 심도있고 다방면의 연구 결과를 바탕으로 유방암, 전립선암, 난소암 등 다양한 난치성 암에서의 특이한 적응증을 확보할 수 있었습니다.
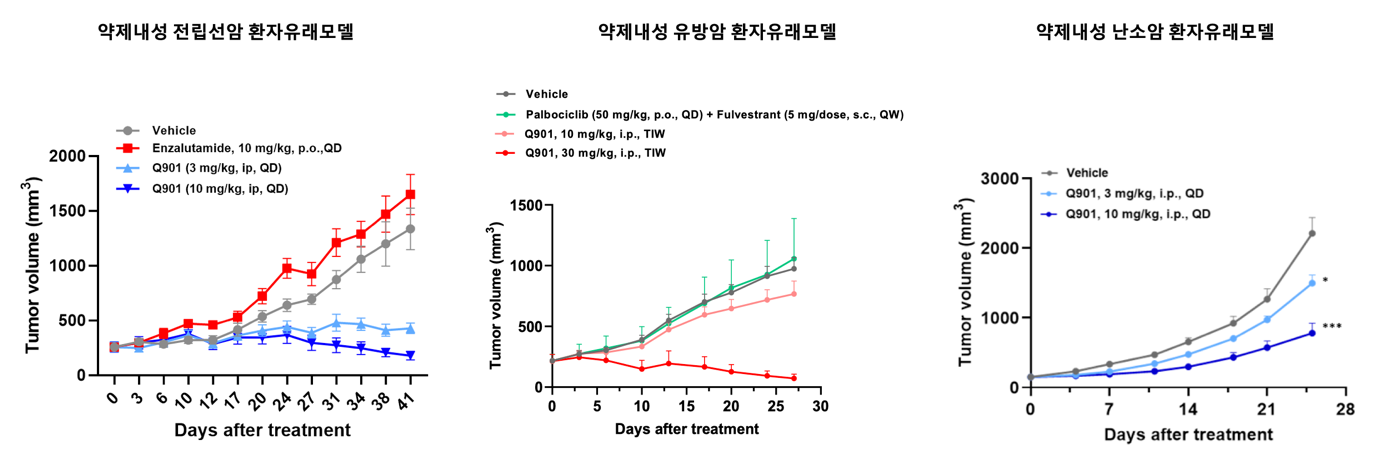
Q901은 2022년 미국 임상 허가를 득하여 기전 연구를 바탕으로 선택된 다양한 고형암 환자 투약을 앞두고 있습니다. Q901 개발의 궁극적 목표는 세포 분열 주기에 문제가 생겨 더 이상 치료 옵션이 사라진 환자들이 지속적으로 정상적인 삶을 영위할 수 있도록 하는 것입니다. 환자들의 삶의 질이 유지될 수록 Q901의 가치도 상승할 것으로 기대 합니다.
 Blog
Blog